[h] Intermolekylära bindningar
[i] INTERMOLEKYLÄRA BINDNINGAR
Niklas Dahrén, kemilektioner.se
[q] Intermolekylära bindningar
[a] De bindningar eller krafter som förekommer mellan molekyler. Dessa räknas som intermolekylära bindningar:
- Jon-dipolbindningar
- Dipol-dipolbindningar
- Vätebindningar
- van der Waalsbindningar (London dispersionskrafter)
[q] Dipoler
[a] Molekyler med 2 elektriskt laddade poler (olika delar eller sidor), varav den ena är partiellt positivt laddad och den andra är partiellt negativt laddad.
[q] Partiell laddning
[a] En ofullständig/delvis positiv eller negativ laddning.
[q] Dipol-dipolbindning
[a] Dipol-dipolbindningen uppstår mellan molekyler som är dipoler. Den partiellt negativa sidan av en dipol attraheras av den partiellt positiva sidan av en annan dipol och tvärtom. Dipol-dipolbindningen är en form av elektrostatisk attraktion.
[q] Vilka 2 kriterium måste vara uppfyllda för att en molekyl ska vara en dipol?
[a] 1. Molekylen måste innehålla olika atomer (olika elektronegativitet så att olika laddningar uppkommer).
2. Molekylen måste ha en osymmetrisk struktur (så att en ojämn laddningsfördelning uppstår).
[q] Är detta en dipol?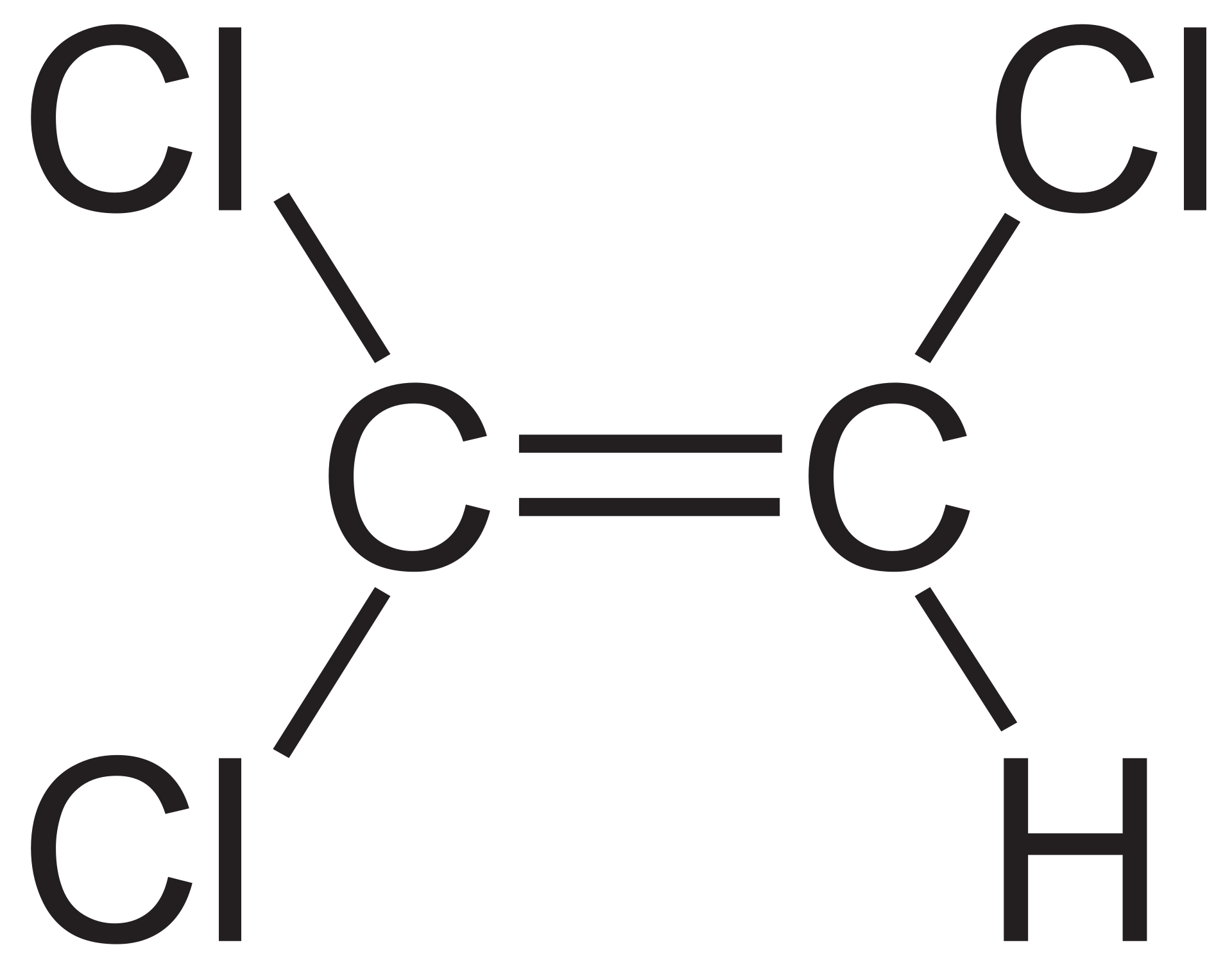
[a] Ja, det är en dipol.
Centrum/tyngdpunkten för de positiva och negativa laddningarna hamnar inte på samma plats i molekylen. Det uppstår alltså en positiv och en negativ pol/sida i molekylen.
[q] Är detta en dipol?
[a] Ja, det är en dipol.
Centrum/tyngdpunkten för de positiva och negativa laddningarna hamnar inte på samma plats i molekylen. Det uppstår alltså en positiv och en negativ pol/sida i molekylen.
[q] Är detta en dipol?
[a] Nej, det är ingen dipol.
Centrum/tyngdpunkten för de positiva och negativa laddningarna hamnar på samma plats i molekylen. Det uppstår alltså ingen positiv resp. negativ pol/sida i molekylen.
[q] Kan denna skapa dipol-dipolbindningar?
[a] Nej, eftersom det inte är någon dipol.
Centrum/tyngdpunkten för de positiva och negativa laddningarna hamnar på samma plats i molekylen. Det uppstår alltså ingen positiv resp. negativ pol/sida i molekylen.
[q] van der Waalsbindningar
[a] van der Waalsbindningen är en bindning mellan temporära (tillfälliga) dipoler.
van der Waalsbindningar liknar vanliga dipol-dipolbindningar men skillnaden är att dessa är mycket svagare och enbart temporära (de uppkommer och upplöses hela tiden).
van der Waalsbindningen är den svagaste intermolekylära bindningen om vi jämför molekyler med samma storlek.
[q] 2 faktorer påverkar den totala styrkan av ett ämnes van der Waalsbindningar
[a]
1. Storleken som ämnets molekyler har:
Större molekyler kan skapa fler van der Waalsbindningar
mellan varandra, i jämförelse med mindre molekyler, vilket därmed innebär
att den totala styrkan av van der Waalsbindningarna blir större.
2. Den geometriska formen som ämnets molekyler har:
[q] Vad påverkar kokpunkten hos ädelgaserna?
[a]
Ädelgaserna har redan ädelgasstruktur och bildar därför inte molekyler. Men när ädelgaserna är i flytande form förekommer det van der Waalsbindningar mellan ädelgasatomerna.
Styrkan av dessa bindningar beror på storleken av atomerna (antalet skal). Fler skal hos atomerna = starkare van der Waalsbindningar.
[q] Vad påverkar kokpunkten hos olika kolväten?
[a] Kolväten kan enbart skapa van der Waalsbindningar mellan sina molekyler. Varje enskild van der Waalsbindning är svag men i stora och avlånga kolväten förekommer det väldigt många van der Waalsbindningar mellan molekylerna vilket innebär att den totala styrkan blir väldigt stor och därmed också kokpunkten. Kokpunkten ökar alltså med storleken av kolvätet.
[q] Vätebindningar
[a] Vätebindningen kan lite förenklat beskrivas som ett specialfall av den vanliga dipol-dipolbindningen, men den är betydligt starkare och den har även ett visst inslag av kovalent bindning (men vätebindningen är inte alls lika stark som en vanlig kovalent bindning).
I en vätebindning binder en starkt partiellt positivt laddad väteatom på en molekyl till en starkt partiellt negativt laddad fluoratom, syreatom eller kväveatom (F, O eller N) på en annan molekyl. Jag kallar detta för ”Hydro-FON-regeln” för att lättare komma ihåg det.
[q] Hydro-FON-regeln
[a] I en vätebindning ska Hydro-FON-regeln ska vara uppfylld mellan molekylerna:
I en vätebindning binder en starkt partiellt positivt laddad väteatom (H) på en molekyl till en starkt partiellt negativt laddad fluoratom, syreatom eller kväveatom (F, O eller N) på en annan molekyl. Jag kallar detta för ”Hydro-FON-regeln” för att lättare komma ihåg det. H binder alltså till F, O eller N.
Hydro-FON-regeln ska även vara uppfylld i vätegivaren:
Hydro-FON-regeln måste, förutom att vara uppfylld mellan molekylerna, även vara uppfylld i den molekyl som bidrar med vätet (i vätegivaren). Om inte Hydro-FON-regeln är uppfylld i vätegivaren så blir inte vätet tillräckligt positivt laddat och då får vi inte en vätebindning mellan molekylerna.
[q] Kan väteklorid (HCl) skapa vätebindningar?
[a] Nej, den uppfyller inte Hydro-FON-regeln.
I molekylen finns det ingen väteatom som binder till antingen F, O eller N.
[q] Kan vatten (H2O) skapa vätebindningar?
[a] Ja, den uppfyller Hydro-FON-regeln.
I molekylen finns det minst en väteatom som binder till antingen F, O eller N.
[q] Kan H2 skapa vätebindningar?
[a] Nej, den uppfyller Hydro-FON-regeln.
I molekylen finns det ingen väteatom som binder till antingen F, O eller N.
[q] Kan vätefluorid (HF) skapa vätebindningar?
[a] Ja, den uppfyller Hydro-FON-regeln.
I molekylen finns det minst en väteatom som binder till antingen F, O eller N.
[q] Kan ammoniak (NH3) skapa vätebindningar?
[a] Ja, den uppfyller Hydro-FON-regeln.
I molekylen finns det minst en väteatom som binder till antingen F, O eller N.
[q] Kan metan (CH4) skapa vätebindningar?
[a] Nej, den uppfyller inte Hydro-FON-regeln.
I molekylen finns det ingen väteatom som binder till antingen F, O eller N.
[x] Niklas Dahrén
kemilektioner.se
[/qdeck]